|
Umbau zu langkettigen n-3-Fettsäuren
ALA wird oftmals als „Basis-Omega-3-Fettsäure“ bezeichnet, da die meisten Organismen (bis auf einige Karnivore) hieraus alle weiteren Omega-3-Fettsäuren synthetisieren können. Der Mechanismus ist mehrstufig und besteht aus dem wiederholten Einfügen von Doppelbindungen (Desaturierung) und Ketten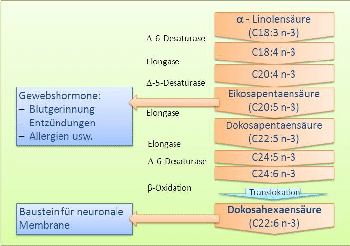 verlängerungen (Elongation). verlängerungen (Elongation).
Das vorläufige Endprodukt ist die Eikosapentaensäure EPA. Alle diese Reaktionen verlaufen am Endoplasmatischen Reticulum. Der erste Schritt, das Einfügen der Doppelbindung in delta-6-Stellung (durch delta-6-Desaturase), ist limitierend für den gesamten Pfad.
Aus EPA wird eine weitere wichtige Omega-3-Fettsäure gebildet: Docosahexaensäure DHA. Dies wird unabhängig von dem vorgeschalteten metabolischen Pfad zur Bildung von EPA geregelt.
Zunächst wird EPA in zwei Elongations- und einem Deasaturierungschritt in (C24:6n-3) umgewandelt. Dieses wird vom Endoplasmatischen Reticulum in Peroxisomen transportiert. Durch beta-Oxidation wird nunmehr DHA gebildet.
ALA als LA-Antagonist
n-3- und n-6-Fettsäuren bilden vergleichbare Reihen. Während ALA die „Basis-Omega-3-Fettsäure“ ist, bildet LA die „Basis-Omega-6- Fettsäure“. Während am Ende der n-3-Reihe EPA (und in der Folge DHA) steht, wird in der n-6-Reihe aus LA Arachidonsäure ARA gebildet.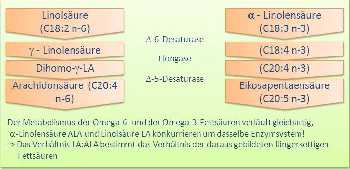
Der Metabolismus der LA und der ALA zu ARA bzw. EPA verläuft gleichartig. Das begrenzte Vorkommen der delta-6-Desaturase ist hierbei das Nadelöhr. Es begrenzt die Gesamtmenge an langkettigen lc-PUFAs nach oben hin. Eine geringfügige Bevorzugung der ALA durch die delta-6-Desaturase findet hierbei statt.
Die zwingende Folgerung aus dieser Tatsache ist, dass das Verhältnis in der Aufnahme von LA zu ALA das Verhältnis von ARA zu EPA bestimmt und damit auch das Verhältnis der daraus gebildeten Eikosanoide.
LA und ALA agieren also kompetitiv um das (begrenzend geregelte) enzymatische System. Ein Überschuss, als auch ein Mangel, an einer der essentiellen Fettsäuren führt somit zwangsläufig zu einem Ungleichgewicht.
Die absolute Menge in der Summe LA + ALA spielt hierbei eine eher untergeordnete Rolle, solange keine extrem fettarme Ernährung zugrunde liegt, was praktisch nie der Fall ist. Die Limitierung des Omega-Metabolismus setzt hier ohnehin Grenzen. Die aktuelle Ernährungssituation so gut wie aller domestizierten Rassen (inklusive Mensch) weist einen ALA- Mangel auf.
Während DHA direkt, insbesondere in neuronalen Membranen, funktionelle Eigenschaften besitzt, beruht die Rolle von EPA insbesondere darauf, als Substrat für wichtige Eikosanoide zu dienen: Thromboxane, Leukotriene und Prostaglandine der 3er-Reihe (von 3 Doppelbindungen). Thromboxane sind Mediatoren für die Thrombozytenaggregation, Leukotriene und Prostaglandine spielen bei Entzündungen eine Schlüsselrolle.
„Effizienz“ der Konvertierung von alpha-Linolensäure
In Abhängigkeit von der Ernährung, dem Alter, Geschlecht und anderen Faktoren werden durchschnittlich 8 – 22 % der mit der Nahrung aufgenommenen ALA zu langkettigen n-3-Fettsäuren konvertiert. Unkritisch reflektiert mag dies wenig erscheinen, so eine häufig publizierte Meinung. Bei genauerer Betrachtung ergibt sich jedoch, dass dies eine adäquate und individuell an die Bedürfnisse angepasste Konvertierungsrate ist.
Es wurde bereits gezeigt, dass es einen die Konvertierungsrate zu EPA limitierenden Faktor gibt: die delta-6-Desaturase. Eine Vielzahl von Studien zeigt auf, dass ab einem bestimmten Blutplasmagehalt an EPA die Menge an delta-6-Desaturase abreguliert wird. Es ist anzunehmen, dass hiermit die Wirkung der langkettigen mehrfach ungesättigten Fettsäuren lcPUFAs reguliert wird. Insbesondere spielt bei der Regulation der individuelle Bedarf eine Schlüsselrolle: Beispielsweise wird die Expression der delta-6-Desaturase in der Schwangerschaft und der Stillzeit signifikant gesteigert, um den erhöhten Bedarf des Fötus bzw. des Säuglings zu erfüllen.
Dies zeigt, dass, ausreichende ALA-Zufuhr vorausgesetzt, der Organismus in der Lage ist, ausreichend EPA aus ALA zu bilden. Darüber hinaus trägt dieser Regulierungsmechanismus dazu bei, das Gleichgewicht der Antagonisten EPA und ARA zu stabilisieren. Unkritische EPA-Zufuhr kann dies durch übermäßiges Herabsetzen der ARA-Bildung zum gegenteiligen Ungleichgewicht verschieben.
Allerdings ist die notwendige Bedingung für eine ausreichende Konvertierung von ALA zu EPA, dass das Verhältnis der beiden essentiellen Fettsäuren nicht zu weit auf Seiten der Linolsäure liegt (siehe „ALA als La-Antagonist“). Dies unterstreicht die Notwendigkeit einer „ausgewogenen Ernährung“. Hier ist also auf eine Reduzierung übermäßiger Linolsäureaufnahme und die Steigerung – notfalls durch Nahrungsergänzung – der alpha-Linolensäureaufnahme von Bedeutung.
DHA wird nach Translokation von (C24:6n-3) in Peroxisomen, speziell der Leberzellen, durch beta-Oxidation synthetisiert. Dieser Vorgang wird unabhängig – und bedarfsorientiert – von der Konvertierung zu EPA gesteuert.
Es gibt den häufig geäußerten Irrtum, DHA wird nicht aus ALA synthetisiert. Dies ist zweifelsfrei widerlegt. Aus praktischen Gründen werden die Lipide zumeist im Blutserum gemessen. DHA ist aber, wenn nicht supplementativ verabreicht wird, kaum im Serum zu finden. Diese Tatsache wurde und wird immer noch dahingehend falsch interpretiert, dass DHA nicht oder kaum aus ALA gebildet wird.
„In vitro“-Studien oder Messungen in der Leber geeigneter tierischer Modelle (z.B. Pavian, ebenfalls omnivor ernährend) oder der Muttermilch zeigen die Fähigkeit zur ausreichenden Biosynthese von DHA aus ALA auf. Sogar die Leber von Föten ist bereits in der Lage, DHA zu synthetisieren.
Fest steht, dass die lcPUFA-Ansprüche selbst für das sich entwickelnde Leben durch diätetische ALA-Zufuhr bei der Mutter gedeckt werden können.
|